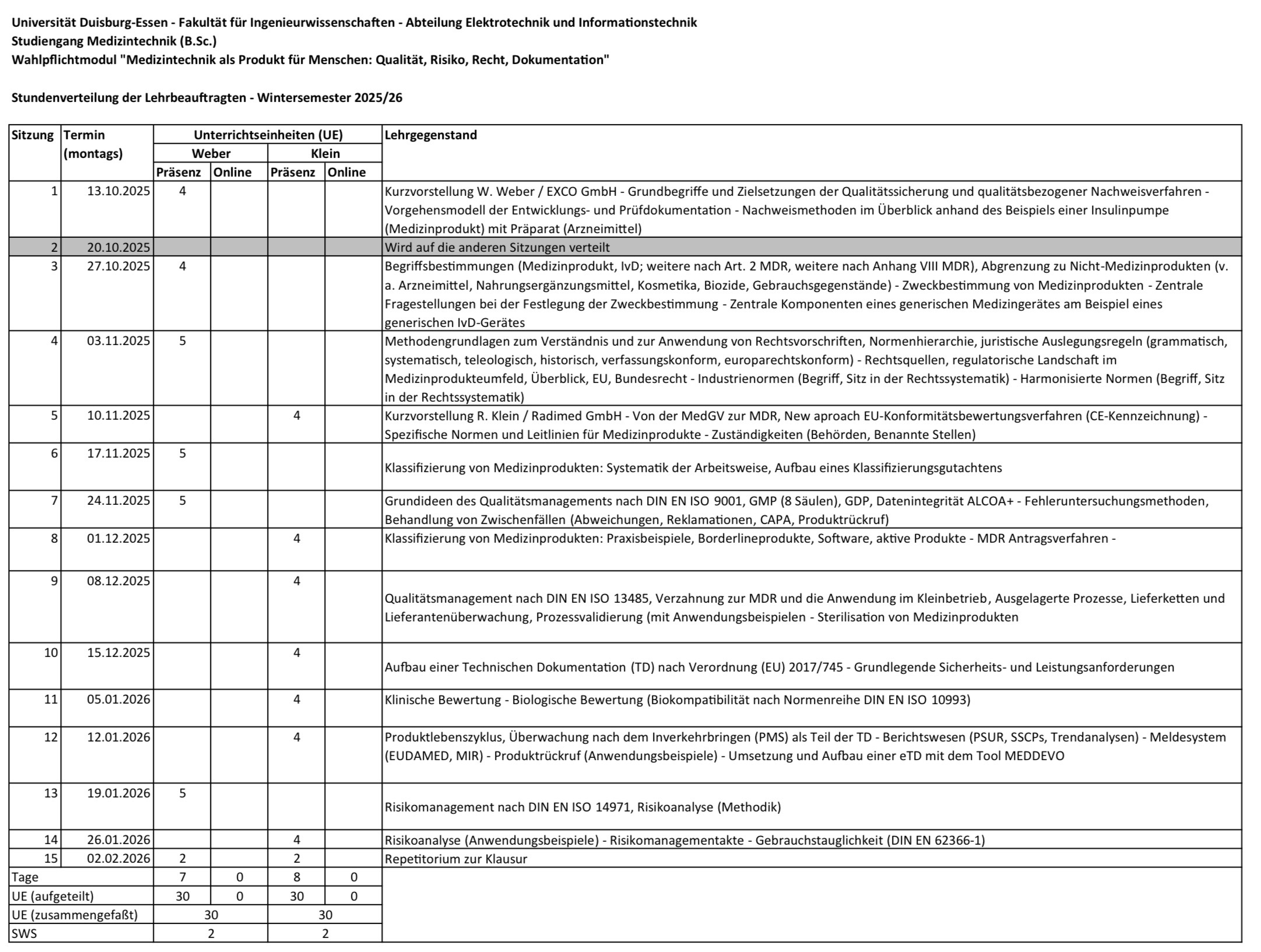
Die Studierenden sollen ein grundlegendes Verständnis dafür entwickeln, wie aus einer Technologie ein für Menschen zugelassenes Medizinprodukt wird. Hierzu sollen sie wichtige Grundbegriffe und Vorgehensweisen zum Inverkehrbringen von Medizinprodukten in der Europäischen Union kennen. Sie sollen über einen Überblick über Regelungen, Aufgabenstellungen und Dokumentationsanforderungen verfügen, die für den Lebenszyklus eines solchen Produktes (Klassifizierung, Konformitätsbewertung, Überwachung nach dem Inverkehrbringen) wesentlich sind. Sie sollen den wesentlichen Aufbau einer Technischen Dokumentation kennen und mit Bezug auf die grundlegenden Sicherheits- und Leistungsanforderungen erläutern können. Sie sollen die unterschiedlichen Anforderungen an unterschiedliche Medizinprodukte-Gruppen identifizieren können. Die Studierenden sollen wichtige Grundbegriffe des Qualitäts- und Risikomanagements kennen und die wesentlichen Zielsetzungen verstehen. Sie sollen verschiedene Vorgehensweisen bei Fehleruntersuchung und Risikoanalyse kennen und zweckdienlich auswählen können.
Wie wird aus einer technischen Entwicklung ein Produkt, das medizinisch am Patienten nicht nur verwendet werden könnte, sondern auch darf? Die Veranstaltung vermittelt einen grundlegenden Einblick in die Begriffe, Ideen und Verfahren, wie Medizinprodukte in der Europäischen Union auf den Markt gebracht und dort gehalten werden dürfen, und zeigt anhand von Beispielen aus der industriellen Praxis, wie es gemacht wird (und wie lieber nicht).
- verantwortliche Lehrperson: Ralf Klein